Trường Sơn
Writer
Ca phẫu thuật tim nhân tạo can thiệp do thiết bị sản xuất trong nước đã chính thức bước vào giai đoạn thương mại hóa, đánh dấu một cột mốc quan trọng trong quá trình phát triển công nghệ tim nhân tạo của Trung Quốc.
Ngày 24/12, thiết bị tim nhân tạo can thiệp đầu tiên do Trung Quốc tự nghiên cứu và sản xuất đã được Cục Quản lý Sản phẩm Y tế Quốc gia phê duyệt lưu hành. Theo dữ liệu đăng ký công khai được First Financial Daily tổng hợp, hiện có hơn mười doanh nghiệp đang tham gia nghiên cứu và phát triển các sản phẩm tim nhân tạo can thiệp trong nước.
Thiết bị vừa được phê duyệt thuộc về Công ty Công nghệ Y tế Core Medical có trụ sở tại Thâm Quyến. Trước đó, một sản phẩm tim nhân tạo khác của doanh nghiệp này từng gây tranh cãi liên quan đến khái niệm công nghệ.
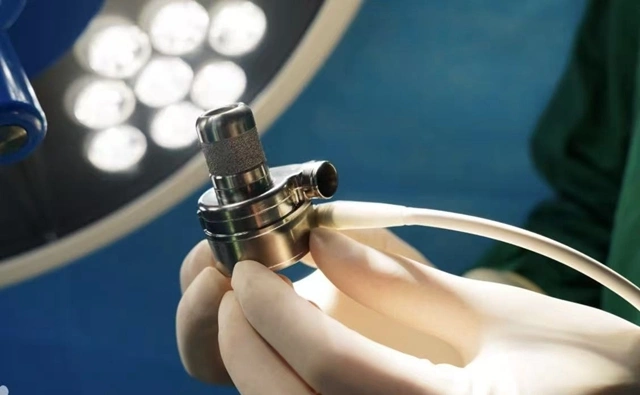
Tim nhân tạo can thiệp, còn gọi là thiết bị hỗ trợ tâm thất trái can thiệp pVAD, là phân khúc còn khá mới trên thế giới. Hiện tại, sản phẩm duy nhất được Cục Quản lý Thực phẩm và Dược phẩm Mỹ phê duyệt là Impella của Abiomed, doanh nghiệp đã được Johnson & Johnson mua lại năm 2022 với giá khoảng 16,6 tỷ USD, tương đương khoảng 420.000 tỷ đồng Việt Nam theo tỷ giá hiện tại. Dù vậy, Impella vẫn chưa được cấp phép tại Trung Quốc và đang trong quá trình xin phê duyệt.
Trước khi pVAD nội địa được thông qua, khái niệm “tim nhân tạo” tại Trung Quốc chủ yếu gắn với tim nhân tạo cấy ghép LVAD. Core Medical là một trong những doanh nghiệp dẫn đầu ở mảng này, với sản phẩm CorHeart6 chiếm hơn 45% thị phần trong nước năm 2024. Tuy nhiên, CorHeart6, được quảng bá là “tim nhân tạo cấy ghép hoàn toàn nâng đỡ bằng từ trường”, gần đây đã bị giới chuyên môn quốc tế đặt câu hỏi.
Trong một thư gửi tạp chí Artificial Organs, một chuyên gia cao cấp cho rằng CorHeart6 sử dụng thuật ngữ dễ gây nhầm lẫn khi mô tả công nghệ. Theo phân tích, thiết bị này chỉ sử dụng ổ trục nâng đỡ bằng từ trường, chứ chưa đạt tiêu chuẩn “hoàn toàn nâng đỡ bằng từ trường” như cách hiểu thống nhất của ngành. Sự khác biệt này có thể ảnh hưởng đến độ an toàn, tỷ lệ biến chứng và tiên lượng lâm sàng. Trên thị trường quốc tế, từng có tiền lệ các thiết bị tim nhân tạo dùng ổ trục từ trường bị thu hồi do lo ngại an toàn.
CorHeart6 được phê duyệt tại Trung Quốc năm 2023, là tim nhân tạo cấy ghép LVAD, khác về chỉ định và phương pháp phẫu thuật so với tim nhân tạo can thiệp vừa được cấp phép.
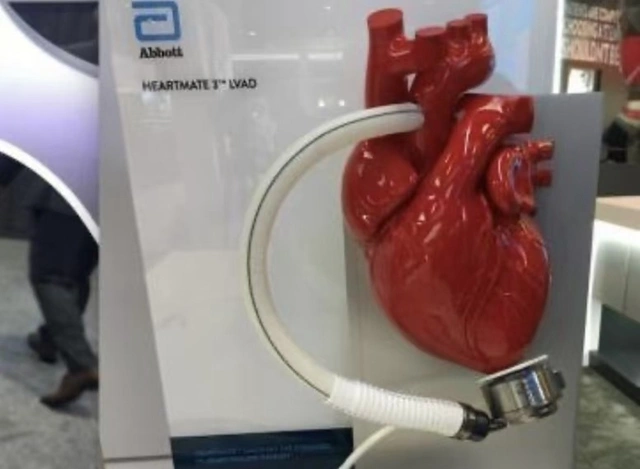
Ở phân khúc LVAD toàn cầu, HeartMate3 của Abbott hiện được coi là tiêu chuẩn ngành với công nghệ nâng đỡ từ trường hoàn toàn và đã được phê duyệt tại Trung Quốc năm 2024. Tuy nhiên, theo thông tin từ CBN, sản phẩm này đã ngừng bán tại Trung Quốc chỉ một năm sau khi được cấp phép, đội ngũ bán hàng cũng đã rút lui, và Abbott chưa công bố lý do chính thức.
Một lãnh đạo doanh nghiệp trong ngành cho biết tim nhân tạo cấy ghép là giải pháp rất xâm lấn, đòi hỏi phẫu thuật phức tạp, theo dõi lâu dài và hỗ trợ kỹ thuật liên tục. Bệnh nhân phải mang thiết bị trong thời gian dài, sạc pin hằng ngày và được giám sát sát sao. Theo vị này, dù tiềm năng công nghệ lớn, rủi ro thương mại của LVAD vẫn cao, trong khi tim nhân tạo can thiệp có quy mô thị trường rộng hơn.
Theo các chuyên gia lâm sàng, tim nhân tạo can thiệp chủ yếu được sử dụng trong các ca can thiệp mạch vành qua da PCI nguy cơ cao hoặc sốc tim cấp. Thiết bị được đưa vào tâm thất trái qua đường ngoại vi và có thể rút ra sau vài giờ, mức độ xâm lấn thấp hơn nhiều so với LVAD, vốn dành cho bệnh nhân suy tim giai đoạn cuối hoặc chờ ghép tim.
Dữ liệu cho thấy chi phí tim nhân tạo cấy ghép rất cao. Tại Mỹ, một hệ thống LVAD có giá trung bình khoảng 175.000 USD, tương đương hơn 4,4 tỷ đồng Việt Nam. Trong khi đó, số ca ghép tim mỗi năm rất hạn chế, khoảng 3.600 ca tại Mỹ và 600 ca tại Trung Quốc, khiến quy mô thị trường LVAD bị giới hạn.
Ngược lại, tim nhân tạo can thiệp là vật tư tiêu hao giá trị cao, thường có giá hàng chục nghìn USD mỗi ca, nhưng áp dụng cho số lượng bệnh nhân lớn hơn nhiều. Theo Frost & Sullivan, năm 2024 thế giới ghi nhận khoảng 2,217 triệu ca PCI nguy cơ cao. Riêng Trung Quốc gần 200.000 ca và dự kiến tăng lên khoảng 772.000 ca vào năm 2033. Sốc tim hiện vẫn là một trong những nguyên nhân tử vong hàng đầu ở bệnh nhân tim mạch, với tỷ lệ tử vong nội viện từ 30 đến 40%.
Chính vì tiềm năng này, hơn mười doanh nghiệp đã tham gia nghiên cứu tim nhân tạo can thiệp, bao gồm Core Medical, Tongling Bionic, Xinqing Medical, Fengkaili, Life Shield và Xinling Maide. Việc sản phẩm đầu tiên được phê duyệt được xem là “phát súng mở màn” cho làn sóng chứng nhận và thương mại hóa trong vài năm tới.
Theo Frost & Sullivan, thị trường tim nhân tạo toàn cầu đã tăng từ 970 triệu USD năm 2019 lên 2,07 tỷ USD năm 2024 và có thể đạt 9,82 tỷ USD vào năm 2033, tương đương khoảng 250.000 tỷ đồng Việt Nam. Tại Trung Quốc, thị trường này được dự báo vượt 11 tỷ nhân dân tệ vào năm 2033, tương đương khoảng 38.000 tỷ đồng.
Dù vậy, giới chuyên môn lưu ý tim nhân tạo vẫn là lĩnh vực có chu kỳ nghiên cứu dài, yêu cầu pháp lý khắt khe và thời gian hoàn vốn lâu. Không phải tất cả doanh nghiệp tham gia đều có thể trụ lại. Ngoài ra, tác động sinh lý lâu dài của dòng máu liên tục trong tim nhân tạo, khác với nhịp đập tự nhiên của tim người, vẫn cần được theo dõi và nghiên cứu thêm.
Về dài hạn, các chuyên gia cho rằng tương lai của tim nhân tạo sẽ hướng tới công nghệ không dây, thiết bị nhỏ gọn hơn và tích hợp trí tuệ nhân tạo, nhằm mở rộng chỉ định điều trị và cải thiện chất lượng sống cho bệnh nhân suy tim.
Ngày 24/12, thiết bị tim nhân tạo can thiệp đầu tiên do Trung Quốc tự nghiên cứu và sản xuất đã được Cục Quản lý Sản phẩm Y tế Quốc gia phê duyệt lưu hành. Theo dữ liệu đăng ký công khai được First Financial Daily tổng hợp, hiện có hơn mười doanh nghiệp đang tham gia nghiên cứu và phát triển các sản phẩm tim nhân tạo can thiệp trong nước.
Thiết bị vừa được phê duyệt thuộc về Công ty Công nghệ Y tế Core Medical có trụ sở tại Thâm Quyến. Trước đó, một sản phẩm tim nhân tạo khác của doanh nghiệp này từng gây tranh cãi liên quan đến khái niệm công nghệ.

Tim nhân tạo can thiệp, còn gọi là thiết bị hỗ trợ tâm thất trái can thiệp pVAD, là phân khúc còn khá mới trên thế giới. Hiện tại, sản phẩm duy nhất được Cục Quản lý Thực phẩm và Dược phẩm Mỹ phê duyệt là Impella của Abiomed, doanh nghiệp đã được Johnson & Johnson mua lại năm 2022 với giá khoảng 16,6 tỷ USD, tương đương khoảng 420.000 tỷ đồng Việt Nam theo tỷ giá hiện tại. Dù vậy, Impella vẫn chưa được cấp phép tại Trung Quốc và đang trong quá trình xin phê duyệt.
Trước khi pVAD nội địa được thông qua, khái niệm “tim nhân tạo” tại Trung Quốc chủ yếu gắn với tim nhân tạo cấy ghép LVAD. Core Medical là một trong những doanh nghiệp dẫn đầu ở mảng này, với sản phẩm CorHeart6 chiếm hơn 45% thị phần trong nước năm 2024. Tuy nhiên, CorHeart6, được quảng bá là “tim nhân tạo cấy ghép hoàn toàn nâng đỡ bằng từ trường”, gần đây đã bị giới chuyên môn quốc tế đặt câu hỏi.
Trong một thư gửi tạp chí Artificial Organs, một chuyên gia cao cấp cho rằng CorHeart6 sử dụng thuật ngữ dễ gây nhầm lẫn khi mô tả công nghệ. Theo phân tích, thiết bị này chỉ sử dụng ổ trục nâng đỡ bằng từ trường, chứ chưa đạt tiêu chuẩn “hoàn toàn nâng đỡ bằng từ trường” như cách hiểu thống nhất của ngành. Sự khác biệt này có thể ảnh hưởng đến độ an toàn, tỷ lệ biến chứng và tiên lượng lâm sàng. Trên thị trường quốc tế, từng có tiền lệ các thiết bị tim nhân tạo dùng ổ trục từ trường bị thu hồi do lo ngại an toàn.
CorHeart6 được phê duyệt tại Trung Quốc năm 2023, là tim nhân tạo cấy ghép LVAD, khác về chỉ định và phương pháp phẫu thuật so với tim nhân tạo can thiệp vừa được cấp phép.
Ở phân khúc LVAD toàn cầu, HeartMate3 của Abbott hiện được coi là tiêu chuẩn ngành với công nghệ nâng đỡ từ trường hoàn toàn và đã được phê duyệt tại Trung Quốc năm 2024. Tuy nhiên, theo thông tin từ CBN, sản phẩm này đã ngừng bán tại Trung Quốc chỉ một năm sau khi được cấp phép, đội ngũ bán hàng cũng đã rút lui, và Abbott chưa công bố lý do chính thức.
Một lãnh đạo doanh nghiệp trong ngành cho biết tim nhân tạo cấy ghép là giải pháp rất xâm lấn, đòi hỏi phẫu thuật phức tạp, theo dõi lâu dài và hỗ trợ kỹ thuật liên tục. Bệnh nhân phải mang thiết bị trong thời gian dài, sạc pin hằng ngày và được giám sát sát sao. Theo vị này, dù tiềm năng công nghệ lớn, rủi ro thương mại của LVAD vẫn cao, trong khi tim nhân tạo can thiệp có quy mô thị trường rộng hơn.
Theo các chuyên gia lâm sàng, tim nhân tạo can thiệp chủ yếu được sử dụng trong các ca can thiệp mạch vành qua da PCI nguy cơ cao hoặc sốc tim cấp. Thiết bị được đưa vào tâm thất trái qua đường ngoại vi và có thể rút ra sau vài giờ, mức độ xâm lấn thấp hơn nhiều so với LVAD, vốn dành cho bệnh nhân suy tim giai đoạn cuối hoặc chờ ghép tim.

Dữ liệu cho thấy chi phí tim nhân tạo cấy ghép rất cao. Tại Mỹ, một hệ thống LVAD có giá trung bình khoảng 175.000 USD, tương đương hơn 4,4 tỷ đồng Việt Nam. Trong khi đó, số ca ghép tim mỗi năm rất hạn chế, khoảng 3.600 ca tại Mỹ và 600 ca tại Trung Quốc, khiến quy mô thị trường LVAD bị giới hạn.
Ngược lại, tim nhân tạo can thiệp là vật tư tiêu hao giá trị cao, thường có giá hàng chục nghìn USD mỗi ca, nhưng áp dụng cho số lượng bệnh nhân lớn hơn nhiều. Theo Frost & Sullivan, năm 2024 thế giới ghi nhận khoảng 2,217 triệu ca PCI nguy cơ cao. Riêng Trung Quốc gần 200.000 ca và dự kiến tăng lên khoảng 772.000 ca vào năm 2033. Sốc tim hiện vẫn là một trong những nguyên nhân tử vong hàng đầu ở bệnh nhân tim mạch, với tỷ lệ tử vong nội viện từ 30 đến 40%.
Chính vì tiềm năng này, hơn mười doanh nghiệp đã tham gia nghiên cứu tim nhân tạo can thiệp, bao gồm Core Medical, Tongling Bionic, Xinqing Medical, Fengkaili, Life Shield và Xinling Maide. Việc sản phẩm đầu tiên được phê duyệt được xem là “phát súng mở màn” cho làn sóng chứng nhận và thương mại hóa trong vài năm tới.
Theo Frost & Sullivan, thị trường tim nhân tạo toàn cầu đã tăng từ 970 triệu USD năm 2019 lên 2,07 tỷ USD năm 2024 và có thể đạt 9,82 tỷ USD vào năm 2033, tương đương khoảng 250.000 tỷ đồng Việt Nam. Tại Trung Quốc, thị trường này được dự báo vượt 11 tỷ nhân dân tệ vào năm 2033, tương đương khoảng 38.000 tỷ đồng.
Dù vậy, giới chuyên môn lưu ý tim nhân tạo vẫn là lĩnh vực có chu kỳ nghiên cứu dài, yêu cầu pháp lý khắt khe và thời gian hoàn vốn lâu. Không phải tất cả doanh nghiệp tham gia đều có thể trụ lại. Ngoài ra, tác động sinh lý lâu dài của dòng máu liên tục trong tim nhân tạo, khác với nhịp đập tự nhiên của tim người, vẫn cần được theo dõi và nghiên cứu thêm.
Về dài hạn, các chuyên gia cho rằng tương lai của tim nhân tạo sẽ hướng tới công nghệ không dây, thiết bị nhỏ gọn hơn và tích hợp trí tuệ nhân tạo, nhằm mở rộng chỉ định điều trị và cải thiện chất lượng sống cho bệnh nhân suy tim.